EL «RECABLEADO» DEL METABOLISMO EN LAS CÉLULAS PRODUCTORAS DE INSULINA PUEDE AYUDAR AL TRATAMIENTO DE LA DIABETES TIPO 2
- Vie 13 de Nov 2020
- Sochob
- Noticias Actuales
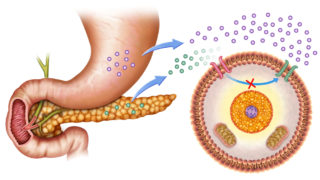
Los investigadores han descubierto una forma previamente desconocida en la que las células pancreáticas deciden cuánta insulina secretar. Podría proporcionar un nuevo objetivo prometedor para desarrollar medicamentos para aumentar la producción de insulina en personas con diabetes tipo 2.
En un par de artículos publicados recientemente en Cell Metabolism, científicos de la Universidad de Wisconsin-Madison y sus colegas señalan una enzima pasada por alto conocida como piruvato quinasa como la forma principal en que las células beta pancreáticas detectan los niveles de azúcar y liberan la cantidad adecuada de insulina .
A partir de varios experimentos de prueba de concepto en roedores y en células pancreáticas humanas, el equipo descubrió que los medicamentos que estimulan la piruvato quinasa no solo aumentan la secreción de insulina, sino que tienen otros efectos protectores metabólicos en el hígado, los músculos y los glóbulos rojos. Los hallazgos sugieren que la activación de la piruvato quinasa podría ser una nueva forma de aumentar la secreción de insulina para contrarrestar la diabetes tipo 2, pero se requeriría más investigación antes de que haya nuevos tratamientos disponibles.
«Demasiada insulina puede reducir el azúcar en sangre a niveles peligrosos, y muy poca insulina puede provocar diabetes», dice Matthew Merrins, profesor de medicina en la Facultad de Medicina y Salud Pública de la Universidad de Washington, quien dirigió el trabajo. «La pregunta que nos hacemos aquí es: ¿cómo los nutrientes como la glucosa y los aminoácidos activan las células beta del páncreas para liberar la cantidad justa de insulina?»
El trabajo se llevó a cabo diseccionando cuidadosamente el momento paradójico de los eventos bioquímicos clave en la comprensión predominante de cómo las células beta pancreáticas responden a los nutrientes en la sangre. Los investigadores apuntan a un modelo nuevo y más rico para comprender cómo se controla este importante proceso que resuelve estas inconsistencias.
Durante décadas, los científicos creyeron que las mitocondrias, los generadores de energía en las células, iniciaban la secreción de insulina. Era una explicación natural, porque las mitocondrias producen la molécula de alta energía ATP, en el proceso agotando la versión de ATP de baja energía, ADP. La caída de ADP estimula el calcio, el desencadenante final para liberar la insulina almacenada.
Pero el momento no tenía sentido. Las mitocondrias son más activas después de que la secreción de insulina ya ha comenzado, no antes. Además, las mitocondrias se detendrían antes de agotar suficiente ADP para desencadenar la secreción de insulina.
Una pista para resolver estas aparentes paradojas provino de estudios realizados en la década de 1980 sobre las células del músculo cardíaco. En ese momento, los científicos descubrieron que la enzima piruvato quinasa, que convierte el azúcar en energía, independientemente de las mitocondrias, también podría agotar gravemente el ADP. Este proceso ocurre cerca de las proteínas sensibles al ADP involucradas en la liberación de insulina en el páncreas. Quizás, pensó el equipo de Merrins, el páncreas aprovechó esta proximidad para ajustar la liberación de insulina.
En los experimentos iniciales, los investigadores suministraron azúcar y ADP a secciones de células pancreáticas que contenían piruvato quinasa. La enzima engulló ambos componentes, agotando el ADP. Debido a que la piruvato quinasa estaba ubicada cerca de la proteína sensible al ADP que desencadena la secreción de insulina, tuvo un gran efecto. «Ese es uno de los conceptos importantes de nuestro artículo: la ubicación del metabolismo es fundamental para su función», dice Merrins.
Utilizando islotes pancreáticos humanos y de ratón, los grupos de células que liberan insulina, los investigadores intentaron estimular la actividad de la piruvato quinasa. Los medicamentos que activan la enzima cuadriplicaron la liberación de insulina, pero solo cuando había suficiente azúcar alrededor, una señal de que no se puede obligar a la piruvato quinasa a liberar demasiada insulina. «La piruvato quinasa no cambia la cantidad de combustible que ingresa a la celda, solo cambia la forma en que se usa ese combustible», dice Merrins. «Los medicamentos que activan la piruvato quinasa aumentan fuertemente la secreción de insulina sin causar demasiada liberación de insulina que puede provocar hipoglucemia».
En total, descubrieron evidencia de una forma más compleja en la que las células beta pancreáticas deciden cuándo y cuánta insulina liberar, similar a un motor de dos ciclos. En el primer ciclo, el azúcar en sangre es procesado por la piruvato quinasa, lo que agota el ADP. Las mitocondrias mantienen el proceso en marcha al alimentar la piruvato quinasa con aún más material, lo que hace que los niveles de ADP se derrumben, lo que finalmente estimula la entrada de suficiente calcio en la célula para liberar insulina. En el segundo ciclo, las mitocondrias cambian de alimentar piruvato quinasa con material a producir la molécula de alta energía ATP, que se necesita para liberar completamente la insulina. Luego, el proceso se reinicia.
En el estudio complementario, dirigido por colegas de Merrins en la Universidad de Yale, los investigadores examinaron cómo los activadores de piruvato quinasa afectaban el metabolismo en ratas sanas y obesas. En una serie de experimentos, encontraron que la activación de la piruvato quinasa aumentaba tanto la secreción de insulina como la sensibilidad a la insulina mientras mejoraba el metabolismo del azúcar en el hígado y los glóbulos rojos . Dichos tratamientos podrían ser útiles para las personas con diabetes tipo 2, que no producen suficiente insulina y, como resultado, tienen un metabolismo del azúcar disfuncional. «La idea terapéutica aquí es que podríamos reconectar el metabolismo para desencadenar de manera más eficiente la secreción de insulina mientras mejoramos la función de otros órganos al mismo tiempo», dice Merrins.
Fuente: https://medicalxpress.com
Referencia: Lewandowski SL, Cardone RL, Foster HR, et al. Pyruvate kinase controls signal strength in the insulin secretory pathway. Cell Metab 2020;32:736-750.
