AKKERMANSIA MUCINIPHILA EN LA PREVENCIÓN Y TRATAMIENTO DE LA OBESIDAD Y SUS COMORBILIDADES
- Lun 15 de May 2017
- Tema del mes
Dr. Alex Valenzuela Montero
Presidente Sociedad Chilena de Obesidad
Docente de la carrera de Nutrición y Dietética de las Universidades del Desarrollo y Mayor
La Akkermansia muciniphila es una bacteria Gram negativa, anaeróbica estricta, miembro de las Verrucomicrobia, que fue descrita en el 2004 formando parte de nuestra microbiota intestinal y de roedores, representando alrededor de un 3% a 5% de las bacterias del total que la componen, lo que la hace una de las más abundantes (1,2). Vive en la capa de moco, donde tiene la capacidad de degradar la mucina a oligosacáridos y ácidos grasos de cadena corta, pero también paradojalmente de promover al mismo tiempo su síntesis, lo cual parece ser crucial para mantener la integridad de la capa de moco intestinal y su adecuada permebailidad (3,4).
La A. muciniphila ha adquirido importancia en el último tiempo por influenciar fuertemente el peso corporal y la salud, estando su cantidad intestinal inversamente relacionada a este y a la presencia de enfermedades metabólicas en roedores y humanos (5). Es así, como en animales y humanos obesos o diabéticos, la mayoría de los estudios señalan que la A. muciniphila se encuentra disminuida, desconociéndose las razones, incrementándose su cantidad con la baja de peso corporal, independiente del mecanismo por el cual esta reducción ponderal se haya logrado (4, 6,7,8,9).
Los sujetos obesos o con sobrepeso que presentan una mayor cantidad fecal de A. muciniphila a nivel basal, tienen mejores parámetros cardiometabólicos, especialmente de glicemia, triglicéridos y distribución de la grasa corporal, en comparación a los obesos que exhiben una menor abundancia (10).
La hipótesis de que la obesidad y sus patologías asociadas pudieran ser controladas modificando la composición y función de la microbiota intestinal, ha llevado a la experimentación especialmente en animales, de la forma de poder incrementar la abundancia selectiva de algunas especies bacterianas, las cuales han demostrado tener efectos beneficiosos, particularmente sobre la salud cardiometabólica (11). En tal sentido, se ha estado ensayando con A. muciniphila en animales y humanos, intentando aumentar su cantidad intestinal a través de diversos procedimientos, que incluyen: suplementos dietarios (prebióticos, polifenoles, capsaicina, ácidos grasos marinos), administración directa (probióticos) y fármacos (metformina) o bien de imitar su acción con componentes proteicos de ella (proteína Amuc_1100) (12,13,14) (Figura 1).
Akkermasia muciniphila y mecanismos de acción
Los mecanismos por los cuales la A. muciniphila produce sus acciones beneficiosas para la salud se conocen solo parcialmente y parecen ser múltiples, siendo mediadas principalmente por un incremento en la producción de moco intestinal (lo que es sorprendente, dado que normalmente degrada mucina) y la síntesis de varios endocannabinoides intestinales que controlan la inflamación, la secreción de enterohormonas y la permeabilidad intestinal (15,16) (Tabla 1). Algunos de estos endocannabinoides, como el 2-oleoilglicerol (2-OG) estimulan la liberación del péptido similar al glucagón 1 y 2 (glucagon-like peptide, GLP-1, GLP-2) de las células L, mientras que el 2-araquidonoilglicerol (2-AG) reduce la endotoxemia metabólica y la inflamación (15,17). Estas enterohormonas están implicadas en la regulación de la homeostasis de la glucosa y metabolismo energético (GLP-1) y en la regulación de la permeabilidad intestinal (GLP-2) (18).
Por su parte, un adecuado grosor de la capa de moco intestinal es imprescindible para el buen funcionamiento de la barrera intestinal y por ende de la permeabilidad intestinal, la cual a su vez es clave en la mantención de la salud, impidiendo el paso de bacterias y derivados de ellas a la circulación sanguínea, como son los lipopolisacáridos (LPS)(19). Estos son componentes de la pared bacteriana de los Gram negativos, los cuales se están produciendo continuamente por lisis bacteriana y pasando a la circulación, siendo capaces de activar el complejo CD14/TLR-4 ubicado en la membrana plasmática de múltiples células, como: adipocitarias, musculares, hepáticas y especialmente inmunes. Ello, desencadena una respuesta inflamatoria (20,21), predisponiendo al desarrollo de diversas patologías, incluyendo: diabetes mellitus tipo 2, dislipidemia, cánceres, enfermedades cardiovasculares, neurodegenerativas y hepáticas (patología grasa no alcohólica) (19,22) (Figura 1).
Figura 1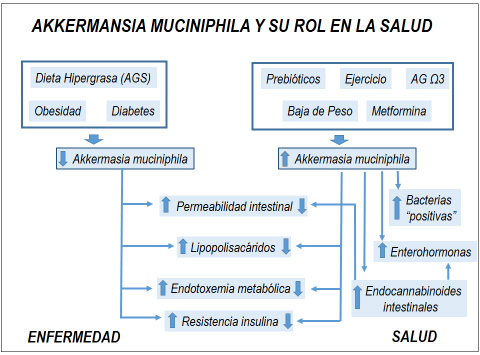
La Akkermansia muciniphila ha sido identificada como una de las bacterias importantes de la microbiota intestinal de animales y humanos que media la salud, al mantener la integridad de la barrera intestinal a través de estimular la producción de moco y endocannabinoides. Se han identificado numerosos factores que promueven el incremento de A, muciniphila intestinal, mientras que por el contrario, una reducción de ella se ha asociado a ciertas enfermedades y a una alimentación rica en grasas saturadas.
Tabla 1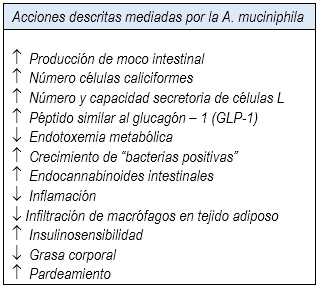
En modelos experimentales de obesidad animal y en aquellos a los cuales se les administra una dieta hipergrasa, se han descrito alteraciones significativas del epitelio intestinal, que se traducen en un aumento anormal de la permeabilidad, facilitando el pasaje exagerado de lipopolisacáridos (LPS) a la circulación (19). Ello, incrementa las concentraciones plasmáticas de LPS entre 2 a 3 veces, lo que se ha denominado endotoxemia metabólica, estimulando el sistema inmune innato, gatillando una respuesta inflamatoria crónica leve mediada por la activación del complejo CD4/Toll like-4 (TLR-4)(19) (Figura 1).
La infusión subcutánea crónica de LPS a ratones (simulando una endotoxemia metabólica) induce inflamación y resistencia a la insulina en una extensión similar a la observada con una dieta hipergrasa, reduciéndose ostensiblemente estas manifestaciones, junto con la endotoxemia metabólica y masa grasa cuando estos ratones reciben antibióticos (22). Además los LPS pueden también estimular la adipogénesis, al incrementar la activación del sistema endocannabinoide periférico (23,24).
Otro mecanismo propuesto por el cual la A. muciniphila podría también contribuir a la salud cardiometabólica, estaría relacionado con su capacidad para producir una variedad de sustratos derivados de la degradación de mucina, incluyendo ácidos grasos de cadena corta, los cuales podrían servir como fuente energética para el crecimiento de otras bacterias beneficiosas, promoviendo así su expansión, y/o tener efectos metabólicos positivos en el huésped (4).
Akkermansia muciniphila y estudios en animales
La dieta hipergrasa ha sido reportada alterar la microbiota intestinal, particularmente incrementando la relación Firmicutes / Bacteroidetes y reducir la abundancia de A. muciniphila, lo que se piensa que pudiera tener un rol contribuyente en la patogénesis de la obesidad y comorbilidades (25,26,27). No obstante, hay que destacar que ratones alimentados con una dieta grasa en donde casi su totalidad proviene de ácidos grasos polinsaturados omega 3, muestran incrementos A. muciniphila intestinal, a diferencia de lo que ocurre en ratones alimentados con igual cantidad de grasas pero mayoritariamente saturadas, que muestran disminución de ella (26).
La administración de oligofructosa a ratones con obesidad genética o inducida por la dieta, incrementa la concentración de A. muciniphila mas de 100 veces, disminuyendo la relación masa grasa / masa muscular y la endotoxemia metabólica y al mismo tiempo mejorando la glicemia, el metabolismo lipídico y la función de barrera intestinal. Además, se incrementó el número de células enteroendocrinas L (27).
Por otra parte, la administración de A. muciniphila viva durante 4 semanas a ratones con obesidad inducida por una dieta hipergrasa, disminuye la ganancia de peso, mejora su perfil metabólico, restaura el engrosamiento de la capa de moco intestinal y contrarresta la endotoxemia y la resistencia insulínica observada habitualmente con este tipo de dieta (4).
En otro estudio se investigó en ratones los efectos de una dieta hipergrasa suplementada con polifenoles, mostrando una reducción en la ganancia de peso y adiposidad, mejoría en la insulinosensibilidad y reducción de marcadores de inflamación intestinal y estrés oxidativo, comparado con los controles (9,12). Estos cambios positivos estuvieron asociados a un incremento entre 7 a 10 veces de A. muciniphila, lo que podría explicar estos resultados (9,12). Es posible que los polifenoles restrinjan el crecimiento de otras bacterias, permitiendo así el sobrecrecimiento de la A. muciniphila.
Plovier et al (14), experimentando recientemente con la administración oral de A. muciniphila pasteurizada (expuesta a 70 ºC) desarrollada en un medio sintético en ratones con una dieta hipergrasa, reportaron que sus propiedades beneficiosas se incrementaron significativamente en comparación a la administración oral de A. muciniphila viva, observándose una mayor capacidad para reducir la masa grasa, resistencia a la insulina y dislipidemia. De acuerdo a los mismos investigadores, todas estas acciones estarían mediadas por la proteína Amuc_1100, una proteína específica aislada de la membrana externa de la A. muciniphila que es estable a la pasteurización y que interactúa con el receptor Toll-like 2 de enterocitos, la cual sería la responsable de mejorar la barrera intestinal y recapitular los efectos beneficiosos de la bacteria (14). Lo anterior, fue corroborado a través de la administración oral de Amuc_1100 a estos roedores, que demostró ser tan efectiva como la administración de A. muciniphila pasteurizada (14).
Estos resultados sustentan el potencial uso de diferentes preparaciones de A. muciniphila o de su proteína Amuc_1100 como opciones terapéuticas para el tratamiento de la obesidad humana y comorbilidades.
Akkermansia muciniphila y salud metabólica en humanos
A diferencia de lo que ocurre en animales, son pocos aún los estudios en humanos que analizan la relación existente entre la abundancia de A. muciniphila y salud cardiometabólica (10). Su rol por tanto permanece poco definido en humanos, aunque se ha reportado una mayor cantidad de ella en sujetos con tolerancia normal a la glucosa en comparación a los prediabéticos, hallazgos que no todos los estudios encuentran. Diferencias en el diseño del estudio, metodología y características de la población analizada, pueden explicar estas discrepancias (28).
En un grupo de 49 sujetos obesos (38) y con sobrepeso (11) que presentaban factores de riesgo cardiovascular fueron sometidos a una dieta hipocalórica por 6 semanas y un adicional de 6 semanas más de mantenimiento del peso corporal, para investigar la relación existente entre marcadores de salud humana, dieta, microbiota intestinal y abundancia de A.muciniphila (10). Entre sus resultados al final del estudio se reporta que la abundancia de esta bacteria en las heces y por tanto a nivel intestinal, se asoció positivamente a insulinosensibilidad y homeostasis glucosídica, como también a mayores beneficios en términos de reducción de la circunferencia cintura y del colesterol plasmático (10). También se señaló que aquellos sujetos que presentaban mayores cantidades de A. muciniphila en sus deposiciones previo al inicio de la restricción calórica, tenían una mejor respuesta en cuanto a mejoría de la glucosa, lípidos plasmáticos y composición corporal después de seguir la dieta. Estos encuentros sugieren que la administración de A. muciniphila en sujetos con obesidad/sobrepeso podría ser una forma novedosa de tratamiento, no existiendo estudios finalizados al respecto que investiguen tal posibilidad, no obstante, que ya está en su fase inicial el primer estudio en un grupo de sujetos adultos con sobrepeso u obesidad asociado a síndrome metabólico (14,29).
Akkermansia muciniphila y metformina
La metformina constituye el fármaco antidiabético más utilizado en la actualidad, disminuyendo la hiperglicemia principalmente a través de sus efectos reductores de la producción hepática de glucosa. Su mecanismo de acción molecular no ha sido completamente dilucidado, postulándose que es a través de la activación de la enzima quinasa dependiente del AMP (AMPK), como consecuencia de una inhibición del complejo 1 de la cadena respiratoria mitocondrial que a su vez elevaba los niveles de AMP intracelular (30). Sin embargo, el hecho de que la acción antihiperglicemiante de la metformina se mantenga intacta cuando se administra oralmente a ratones que carecen de AMPK a nivel hepático (31) o bien que este efecto solo se observe con altas dosis de metformina, sugieren que otros mecanismos supresores de la producción hepática de glucosa están también presentes. En tal sentido, existe una evidencia creciente que la metformina ejerce muchas de sus acciones antihiperglicemiantes a nivel intestinal (13,32,33), entre ellas, que sus acciones solo se observan si se administra por vía oral y no endovenosa (34) y que la metformina de acción retardada, la cual tiene una baja biodisponibilidad y por tanto interactúa preferente en el intestino, tiene una eficacia superior a la metformina convencional de liberación inmediata o de liberación extendida (35).
Entre los mecanismos propuestos por los cuales la metformina realiza sus acciones antihiperglicemiantes están: incremento y secreción de GLP-1, reducción de la DPP4, activación eje intestino-cerebro-hígado, aumento de la gluconeogénesis intestinal y de la concentración de ácidos biliares intestinales y finalmente modificaciones de la microbiota intestinal (36).
Estudios realizados en animales y humanos establecen que la metformina modifica la microbiota intestinal, observándose especialmente un incremento significativo de la bacteria A. muciniphila y de las células caliciformes productoras de mucina (13,32,37,38,39,40). Si bien los estudios de la microbiota intestinal en humanos tratados con metformina son más escasos (39,40,41), existen reportes que mujeres diabéticas en tratamiento con ella tienen una microbiota intestinal diferente, exhibiendo mayores concentraciones de A. muciniphila, comparadas con aquellas que no la toman (41). Resultados similares son descritos en un grupo de sujetos diabéticos colombianos en tratamiento con metformina, donde también se reporta un incremento de A. muciniphila junto con algunas bacterias intestinales reconocidas por su producción de ácidos grasos de cadena corta, en comparación a aquellos sin el fármaco (40).
Shin et al (13), en un interesante estudio reportan que ratones con dietas hipergrasas tratados ya sea con metformina o con A. muciniphila cultivada, exhiben similares respuestas en reducir la glicemia, la inflamación (IL-6) y en restaurar la producción de mucina por las células caliciformes, lo que lleva a pensar que la A. muciniphila por si sola puede explicar los efectos beneficiosos de la metformina, aunque se requieren más estudios para establecerlo.
Akkermansia muciniphila y exposición al frío
Un sorprendente hallazgo fue descrito en la microbiota de ratones expuestos al frío (6 ºC) durante 11 o 30 días (42). En ellos se observó en sus heces un incremento en la relación Firmicutes/Bacteroidetes y una desaparición casi total de la A. muciniphila, es decir cambios similares a los descritos en la microbiota intestinal de ratones obesos y que se asocian a un incremento en la extracción de energía de los alimentos consumidos. Conjuntamente se observó una reducción del peso corporal y de la glicemia inicialmente y un aumento de la insulinosensibilidad, los cuales fueron atribuidos al incremento del gasto energético producido por la exposición al frío, en concordancia con un incremento de adipocitos beige en tejido adiposo blanco, proceso conocido como “pardeamiento”.
Lo interesante que se describió en este mismo estudio (42), es que si a la microbiota de ratones expuestos al frío se le incorpora A. muciniphila y se trasplanta a ratones carentes de ella, el efecto del frío sobre la absorción intestinal se anula, sin embargo se mantienen la insulinosensibilidad y el pardeamiento.
Akkermansia muciniphila y ejercicio
Se conoce que el ejercicio físico regular modifica la microbiota intestinal de animales y humanos, en especial incrementando su diversidad y reduciendo el número de bacterias patógenas, aunque son pocos los estudios hasta el presente que investigan tal asociación (43). Clarke et al (44), analizando la microbiota fecal de un grupo de jugadores profesionales de rugby, encuentran que estos tienen una microbiota diferente y una cantidad menor de marcadores inflamatorios circulantes, comparado al grupo control sedentario. En ellos se observó una mayor abundancia de A. muciniphila en sus muestras fecales, no obstante que no se puede descartar que estos cambios sean mediados no solo por el ejercicio, sino también por la dieta hiperproteica que estos jugadores tenían (44). Sin embargo, la evidencia existente indica que la microbiota es sensible a los cambios homeostáticos y fisiológicos producidos por el ejercicio, pero se requieren más estudios intervencionales para determinar la causalidad y los mecanismos por los cuales esto ocurre.
Es de interés destacar que el ejercicio intenso y prolongado, como el desarrollado por algunos atletas profesionales, podría ser contraproducente, al generar una alteración en la permeabilidad intestinal, incrementando el pasaje de LPS a la circulación, lo que se ha atribuido a la hipoperfusión esplácnica, isquemia y a la reperfusión subsiguiente (45).
Akkermansia muciniphila y cirugía bariátrica
Existe cada vez más evidencia científica que sugiere que los buenos resultados obtenidos con la cirugía bariátrica, en términos de pérdida de peso corporal y remisión de comorbilidades, no depende en su totalidad de la reducción de la capacidad gástrica y/o menor absorción intestinal. Otros factores han sido implicados en el éxito de ella, como la modificación de enterohormonas, concentración de ácidos biliares intestinales y plasmáticos y cambios en la microbiota intestinal (46,47).
Es un hecho demostrado que la cirugía bariátrica modifica positivamente la microbiota intestinal en animales y humanos hacia un perfil menos obesogénico, por lo general, incrementando la diversidad microbiana y reestableciendo la proporción alterada de Firmicutes / Bacteroidetes y las concentraciones disminuidas de A. muciniphila (48). Estos cambios bacterianos intestinales en ratones con bypass gástrico en Y de Roux, especialmente un incremento significativo de Verrucomicrobia (Akkermansia) y Gammaproteobacteria (Escherichia) en las muestras fecales, que también son descritos en sujetos operados con igual técnica, ocurren muy tempranamente postcirugía, alrededor de una semana, para estabilizarse hacia la quinta semana y permanecer sin modificación, independiente de la dieta que sigan posteriormente (6). Similares modificaciones positivas en la microbiota intestinal han sido descritas también en modelos de ratas obesas y diabéticas con manga duodenoyeyunal endoscópica (Endobarrier ®), incluyendo un incremento de la A. muciniphila (49).
Si bien, todas las técnicas bariátricas reportan modificaciones en la microbiota intestinal en animales y humanos, existen discrepancias en cuanto al tipo y magnitud de esta, en parte debido probablemente a la escasez de trabajos realizados que la investigan, especialmente en humanos. No obstante, existe cierto consenso en que el bypass gástrico en Y de Roux tendría un impacto favorable mayor, en comparación a otros procedimientos bariátricos, observándose particularmente un incremento en la abundancia de Bacteroidetes, Verrucomicrobia (Akkermansia) y Gammaproteobacteria (Escherichia) (50).
Ratones libres de microbiota intestinal de peso normal a los cuales se les realiza un trasplante de microbiota intestinal proveniente de ratones obesos con cirugía bariátrica previa (bypass gástrico en Y de Roux), experimentan reducción de peso (alrededor de un 5%), grasa corporal y glicemia, en comparación al grupo control que recibió trasplante fecal proveniente de ratones con cirugía falsa, en quienes no se evidenciaron cambios (6). Este es el primer estudio en demostrar que los beneficios de la cirugía bariátrica, pueden parcialmente ser mediados por modificaciones en la microbiota intestinal (6).
Trabajos posteriores realizados en humanos, como se mencionó, establecieron que estas modificaciones en la microbiota intestinal, también se presentan en pacientes con bypass gástrico en Y de Roux y con la gastroplastía vertical anillada, permaneciendo a lo largo del tiempo, siendo independientes del IMC (51). El trasplante de microbiota fecal de estos pacientes operados a ratones libres de microbiota intestinal, hace que estos acumulen sustancialmente menos grasa corporal y tengan un metabolismo alterado, lo que ratifica los hallazgos descritos inicialmente en ratones, en que las modificaciones de la microbiota intestinal originada por la cirugía tendría una participación de causalidad en los resultados obtenidos con ella (52).
Son numerosos los mecanismos posibles involucrados en la modificación de la microbiota intestinal postcirugía bariátrica (47,52), parte de los cuales son mencionados en la figura 2.
Figura 1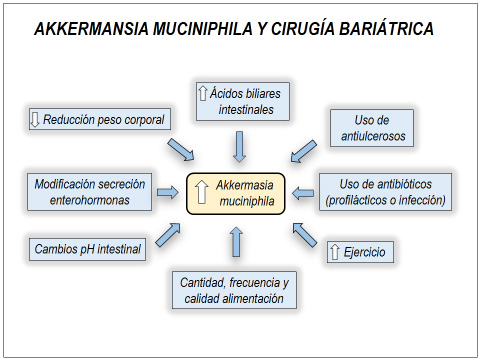
La cirugía bariátrica incrementa la abundancia de A. muciniphila en el intestino a través de múltiples vías, lo que puede explicar parte de sus importantes acciones metabólicas beneficiosas descritas, además de la reducción de peso corporal descritas en animales.
Experimentos en humanos obesos con Akkermansia muciniphila
En Diciembre del 2015 se inició un estudio intervencional, randomizado, en la University Clinics of Saint-Luc (Bélgica) denominado Microbes4U, cuyo objetivo es observar si la administración oral de A. muciniphila viva o pasteurizada suministrada diariamente por 3 meses es segura y si tiene algún impacto beneficioso sobre el peso corporal y parámetros metabólicos en pacientes adultos obesos/sobrepeso (18 a 70 años, IMC > 25 kg/m2) y con síndrome metabólico. Al menos inicialmente en la primera etapa del estudio se reportó que la administración de la bacteria es segura para los humanos. Se estima que los resultados finales estarán para diciembre del 2017 (14,29).
Referencias
1.- Derrien M, Vaughan EE, Plugge CM, et al. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium. Int J Syst Evol Microbiol 2004;54:1469-1476.
2.- Collado MC, Derrien M, Isolauri E, et al. Intestinal integrity and Akkermansia muciniphila, a mucin-degrading member of the intestinal microbiota present in infants, adults, and the elderly. Appl Environ Microbiol 2007;73:7767-7770.
3.- Derrien M, Van Baarlen P, Hooiveld G, et al. Modulation of mucosal immune response, tolerance, and proliferation in mice colonized by the mucin-degrader Akkermansia muciniphila. Front Microbiol 2011 Aug 1;2:166.
4.- Everard A, Belzer C, Geurts L, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. Proc Natl Acad Sci USA 2013;110:9066-9071.
5.- Belzer C, de Vos WM. Microbes inside–from diversity to function: the case of Akkermansia. ISME J 2012;6:1449-1458.
6.- Liou AP, Paziuk M, Luevano Jr JM, et al. Conserved shifts in the gut microbiota due to gastric bypass reduce host weight and adiposity. Sci Transl Med 2013;5(178):178ra41.
7.- Karlsson CL, Onnerfält J, Xu J, et al. The microbiota of the gut in preschool children with normal and excessive body weight. Obesity 2012;20:2257-2261.
8.- Zhang H, DiBaise JK, Zuccolo A, et al. Human gut microbiota in obesity and after gastric bypass. Proc Natl Acad Sci USA 2009;106:2365-2370.
9.- Roopchand DE, Carmody RN, Kuhn P, et al. Dietary polyphenols promote growth of the gut bacterium Akkermansia muciniphila and attenuate high-fat diet-induced metabolic syndrome. Diabetes 2015;64:2847-2858.
10.- Dao MC, Everard A, Aron-Wisnewsky J, et al. Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity: relationship with gut microbiome richness and ecology. Gut 2016;65:426-436.
11.- Burcelin R, Courtney M, and Amar, J. (2015). “GM and metabolic diseases: from pathogenesis to therapeutic perspective,” in Metabonomics and Gut Microbiotain Nutrition and Disease, eds S. Kochhar and F.-P. Martin (London: Springer),199-234.
12.- Anhê FF, Roy D, Pilon G, et al. A polyphenol-rich cranberry extract protects from diet-induced obesity, insulin resistance and intestinal inflammation in association with increased Akkermansia spp. population in the gut microbiota of mice. Gut 2015;64:872-883.
13.- Shin N-RR, Lee J-CC, Lee H-YY, et al. An increase in the Akkermansia spp. population induced by metformin treatment improves glucose homeostasis in diet-induced obese mice. Gut 2014;63:727-735.
14.- Plovier H, Everard A, Druart C, et al. A purified membrane protein from Akkermansia muciniphila or the pasteurized bacterium improves metabolism in obese and diabetic mice. Nat Med 2017;23:107-113.
15.- Alhouayek M, Muccioli GG. The endocannabinoid system in inflammatory bowel diseases: from pathophysiology to therapeutic opportunity. Trends Mol Med 2012;18:615-625.
16.- Cani PD, Everard A, Duparc T. Gut microbiota, enteroendocrine functions and metabolism. Curr Opin Pharmacol 2013;13:935-940.
17.- Hansen KB, Rosenkilde MM, Knop FK, et al. 2-Oleoyl glycerol is a GPR119 agonist and signals GLP-1 release in humans. J Clin Endocrinol Metab 2011;96:E1409-E1417.
18.- Cani PD, Possemiers S, Van de Wiele T, et al. Changes in gut microbiota control inflammation in obese mice through a mechanism involving GLP-2 driven improvement of gut permeability. Gut 2009;58:1091-1103.
19.- Cani PD, Amar J, Iglesias MA, et al. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes 2007;56:1761-1772.
20.- Kawai T, Akira S. The role of pattern-recognition receptors in innate immunity: update on toll-like receptors. Nat Immunol 2010;11:373-841.
21.- Sasai M, Yamamoto M. Pathogen recognition receptors: ligands and signaling pathways by toll-like receptors. Int Rev Immunol 2013;32:116-133.
22.- Cani PD, Bibiloni R, Knauf C, et al. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice. Diabetes 2008;57:1470-1481.
23.- Turnbaugh PJ, Gordon JI. The core gut microbiome, energy balance and obesity. J Physiol 2009;587:4153-4158.
24.- Muccioli GG, Naslain D, Bäckhed F, et al. The endocannabinoid system links gut microbiota to adipogenesis. Mol Syst Biol. 2010 Jul;6:392.
25.- Cani PD, Neyrinck AM, Fava F, et al. Selective increases of bifidobacteria in gut microflora improve high-fat-diet-induced diabetes in mice through a mechanism associated with endotoxaemia. Diabetologia 2007;50:2374-2383.
26.- Caesar R, et al. Crosstalk between gut microbiota and dietary lipids aggravates wat inflammation through TLR signaling. Cell Metab 2015;22:658-668.
27.- Everard A, Lazarevic V, Derrien M, et al. Responses of gut microbiota and glucose and lipid metabolism to prebiotics in genetic obese and diet-induced leptin-resistant mice. Diabetes 2011;60:2775-2786.
28.- Qin J, Li Y, Cai Z, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature 2012;490:55-60.
29.- http://www.microbes4u.be/presentation.html (Consultado enero 2017).
30.- Shaw RJ, Lamia KA, Vasquez D, et al. The kinase LKB1 mediates glucose homeostasis in liver and therapeutic effects of metformin. Science 2005;310:1642-1646.
31.- Foretz M, Hébrard S, Leclerc J, et al. Metformin inhibits hepatic gluconeogenesis in mice independently of the LKB1/AMPK pathway via a decrease in hepatic energy state. J Clin Invest 2010;120:2355-2369.
32.- Lee H, Ko G. Effect of metformin on metabolic improvement and gut microbiota. Appl Environ Microbiol 2014;80:5935-5943.
33.- Bonora E, Cigolini M, Bosello O, et al. Lack of effect of intravenous metformin on plasma concentrations of glucose, insulin, C-peptide, glucagon and growth hormone in non-diabetic subjects. Curr Med Res Opin 1984;9:47-51.
34.- Sum CF, Webster JM, Johnson AB, et al. The effect of intravenous metformin on glucose metabolism during hyperglycaemia in type 2 diabetes. Diabet Med 1992;9:61-65.
35.- Buse JB, DeFronzo RA, Rosenstock J et al. The primary glucose-lowering effect of metformin resides in the gut, not the circulation: results from short-term pharmacokinetic and 12-week dose-ranging studies. Diabetes Care 2016;39:198-205.
36.- McCreight LJ, Bailey CJ, Pearson ER. Metformin and the gastrointestinal tract. Diabetologia 2016;59:426-435.
37.- Zhang X, Zhao Y, Xu J, et al. Modulation of gut microbiota by berberine and metformin during the treatment of high-fat diet-induced obesity in rats. Sci Rep 2015;5:14405.
38.- Forslund K, Hildebrand F, Nielsen T, et al. MetaHIT consortium. Disentangling type 2 diabetes and metformin treatment signatures in the human gut microbiota. Nature 2015;528:262-266.
39.- Napolitano A, Miller S, Nicholls AW, et al. Novel gut-based pharmacology of metformin in patients with type 2 diabetes mellitus. PLoS One 2014;9:e100778.
40.- de la Cuesta-Zuluaga J, Mueller NT, Corrales-Agudelo V, et al. Metformin is associated with higher relative abundance of mucin-degrading akkermansia muciniphila and several short- chain fatty acid–producing microbiota in the gut. Diabetes Care 2017;40:54-62.
41.- Karlsson FH, Tremaroli V, Nookaew I, et al. Gut metagenome in European women with normal, impaired and diabetic glucose control. Nature 2013;498:99-103.
42.- Chevalier C, Stojanović O, Colin DJ, et al. Gut microbiota orchestrates energy homeostasis during cold. Cell 2015;163:1360-1374.
43.- Campbell SC, Wisniewski PJ. Exercise is a novel promoter of intestinal health and microbial diversity. Exerc Sport Sci Rev 2017;45:41-47.
44.- Clarke SF, Murphy EF, O’Sullivan O, et al. Exercise and associated dietary extremes impact on gut microbial diversity. Gut 2014;63:1913–1920.
45.- Bosenberg AT, Brock-Utne JG, Gaffin SL, et al. Strenuous exercise causes systemic endotoxemia. J Appl Physiol 1988;65:106-108.
46.- Chakravartty S, Tassinari D, Salerno A, et al. What is the mechanism behind weight loss maintenance with gastric bypass? Curr Obes Rep 2015;4:262-268.
47.- Seeley RJ, Chambers AP, Sandoval DA. The role of gut adaptation in the potent effects of multiple bariatric surgeries on obesity and diabetes. Cell Metab 2015;21:369-378.
48.- Li J, Ashrafian H, Bueter M, et al. Metabolic surgery profoundly influences gut microbial-host metabolic cross-talk. Gut 2011;60:1214-1223.
49.- Kim T, Holleman CL, Ptacek T. Duodenal endoluminal barrier sleeve alters gut microbiota of ZDF rats. Int J Obes 2017;41:381-389.
50.- Murphy R, Tsai P, Jüllig M, et al. Differential changes in gut microbiota after gastric bypass and sleeve gastrectomy bariatric surgery vary according to diabetes remission. Obes Surg 2017;27:917-925.
51.- Tremaroli V, Karlsson F, Werling M, et al. Roux-en-Y gastric bypass and vertical banded gastroplasty induce long-term changes on the human gut microbiome contributing to fat mass regulation. Cell Metab 2015;22:228-238.
52.- Aron-Wisnewsky J, Doré J, Clement K. The importance of the gut microbiota after bariatric surgery. Nat Rev Gastroenterol Hepatol 2012;9:590-598.
Articulos Anteriores
TRASPLANTE DE MICROBIOTA FECAL Y OBESIDAD
CONTRAVE: la nueva esperanza farmacológica para la obesidad
LORCASERIN : ¿una esperanza menos?
SIBUTRAMINA: En espera de una sentencia definitiva
Rigidez Arterial y Riesgo Vascular
Obesidad: Una mirada más allá de la sobrealimentación y el sedentarismo.
Visfatina: Una puesta al día
Diabetes e Hipogonadismo Hipogonadotrófico
